Si tout l’argent dépensé pour les budgets militaires dans tous les pays avait été consacré à la recherche biologique, la question de l’immortalité, ou du moins de la jeunesse éternelle, aurait déjà été résolue. (traduction). Jean Rostand. Biologiste français, décédé en 1977.
Le parcours de Heales : célébration des 200 éditions de la lettre d’information
Retour sur la première édition
Alors que nous atteignons la 200e édition de Death of the Death, il convient de revenir brièvement sur la toute première newsletter publiée en janvier 2009. Le numéro 0 présentait l’ambition de suivre les progrès scientifiques liés à la longévité humaine, en mettant l’accent sur la possibilité de retarder, voire de surmonter, la mortalité liée à l’âge.
La newsletter présentait le concept de « vitesse d’échappement de la longévité », l’hypothèse selon laquelle si les progrès de la biomédecine augmentent l’espérance de vie plus rapidement que le temps ne la réduit, chaque génération de progrès pourrait permettre à la suivante de voir le jour. À l’époque, cette idée émergeait dans les milieux de la recherche, et la newsletter visait à la rendre accessible et à suivre les développements dans des domaines tels que la régénération, les cellules souches et les mécanismes du vieillissement.
Seize ans plus tard, ce 200e numéro marque une continuité plutôt qu’une conclusion. Nous en savons plus, nous vivons en moyenne plus longtemps, mais la durée de vie maximale ne s’est pas allongée. Les mêmes questions restent ouvertes, les mêmes domaines scientifiques continuent d’évoluer et l’objectif initial persiste : documenter les progrès, les défis et les perspectives de la science de la longévité au fil du temps.
Pour cette newsletter, nous vous proposons 200 informations sur la longévité et sur notre organisation. Elles sont regroupées en 16 catégories. Il est impossible d’être complet et objectif, mais nous avons essayé.
Top scientifiques/personnalités de la géroscience
Personnalités célèbres ayant vécu plus de 100 ans
Organisations pour la longévité
Présence de Heales lors de certaines conférences et activités
Conférences de Heales
Heales dans les médias
Activités soutenues par Heales
Sport et exercice physique liés à la longévité
Les aliments qui pourraient contribuer à la longévité
Facteurs sociaux favorisant la longévité
Biomarqueurs de la longévité
Gènes liés à la longévité
Produits favorisant la longévité
Faits moins connus dans la recherche sur le vieillissement
Mauvaises nouvelles (un long chemin à parcourir)
Découvertes et technologies
Les meilleurs scientifiques et personnalités dans le domaine de la gérontologie
- Nir Barzilai. médecin généticien spécialisé dans le vieillissement, les gènes de la longévité et les interventions telles que la metformine (Institut de recherche sur le vieillissement). Promoteur du projet TAME.
- Irina Conboy. ses études sur la parabiose hétérochronique et la dilution plasmatique ont révélé comment les facteurs systémiques régulent le vieillissement et la réparation.
- José Cordeiro. Auteur futuriste et transhumaniste prônant l’allongement radical de la durée de vie et la fin du vieillissement involontaire.
- Aubrey de Grey., gérontologue biomédical et défenseur des biotechnologies de revitalisation (Fondation LEV).
- Greg Fahy. A dirigé des études sur la régénération du thymus humain (TRIIM), un essai immunologique historique sur le vieillissement.
- Steven Horvath. Créateur de l’horloge épigénétique, l’un des biomarqueurs les plus influents de la biologie moderne du vieillissement. Ses horloges de méthylation de l’ADN sont utilisées dans le monde entier pour mesurer l’âge biologique et évaluer les interventions de rajeunissement.
- Bryan Johnso., Entrepreneur à la tête du Blueprint Project, une expérience extrême basée sur des données visant à ralentir et inverser le vieillissement biologique chez l’homme.
- Brian Kennedy. Professeur émérite en longévité saine et biochimie ; leader de longue date dans le domaine de la biologie du vieillissement.
- Cynthia Kenyon. Biologiste moléculaire dont les travaux sur C. elegans ont révolutionné la génétique du vieillissement.
- James L. Kirkland. Directeur du Robert and Arlene Kogod Center on Aging de la Mayo Clinic, pionnier des sénolytiques, il a démontré que l’élimination des cellules sénescentes améliore la durée de vie en bonne santé. Ses travaux ont contribué à établir le dasatinib et la quercétine comme composés sénolytiques de première génération.
- Andrea Maier. Éminente clinicienne spécialisée dans la médecine de la longévité et défenseure d’une traduction équitable de la gérontologie.
- João Pedro de Magalhães. Gérontologue computationnel de premier plan, connu pour ses travaux sur la génomique de la longévité, la biologie comparative et la création des ressources génomiques sur le vieillissement humain (HAGR). Ses travaux portent sur la découverte de médicaments basés sur l’IA et l’évolution de la durée de vie chez différentes espèces.
- Élie (Ilya) Metchnikoff (†). Souvent considéré comme le père de la gérontologie. Il a inventé le terme « gérontologie » en 1903 pour décrire la nouvelle discipline scientifique consacrée à l’étude du vieillissement et de la longévité. Il a reçu le prix Nobel en 1908 pour ses travaux sur l’immunité et a consacré ses dernières recherches au concept de longévité humaine. Ses travaux ont jeté les bases des études modernes sur le vieillissement et se sont concentrés sur l’hypothèse selon laquelle le vieillissement était le résultat d’une auto-intoxication chronique par les bactéries intestinales.
- Liz Parrish. PDG de BioViva, connue pour avoir été la première à mener des expériences de thérapie génique auto-administrée visant à inverser le vieillissement.
- David Sinclair. Biologiste à Harvard et auteur populaire sur les mécanismes du vieillissement (par exemple, les voies sirtuines/NAD).
- Shinya Yamanaka. Chercheur en cellules souches lauréat du prix Nobel qui a découvert les cellules souches pluripotentes induites (iPS), fondamentales pour la recherche sur la reprogrammation cellulaire et le rajeunissement.
- Alex Zhavoronkov. Fondateur et PDG d’Insilico Medicine, figure de proue de la découverte de médicaments basée sur l’IA et de la gérontologie computationnelle. Ses travaux portent notamment sur le développement d’horloges biologiques basées sur l’apprentissage profond et de biomarqueurs multi-omiques pour l’âge biologique.
Personnalités célèbres ayant vécu plus de 100 ans
18. Jeanne Calment (122) (†). La femme la plus âgée de tous les temps.
19. Jiroemon Kimura (116) (†). L’homme le plus âgé de tous les temps.
20. Kane Tanaka (119) (†)
21. Sarah Knauss (119) (†)
22. Terentia (103) (†). Empire romain. Veuve de Cicéron.
23. Edgar Morin (104). Le philosophe connu le plus âgé.
24. Kirk Douglas (103) (†).
Organisations pour la longévité
25. Google Calico. Se concentre à la fois sur la recherche fondamentale et sur la traduction de nos découvertes en nouvelles interventions pouvant aider les gens à vivre plus sainement, et peut-être plus longtemps.
26. Chan Zuckerberg Initiative (pas « officiellement » dédiée à la longévité). Fondée en 2015, cette initiative vise à aider à résoudre certains des défis les plus difficiles de la société, qu’il s’agisse d’éradiquer les maladies, d’améliorer l’éducation ou de répondre aux besoins de nos communautés locales.
27. Altos Labs. Restaure la santé et la résilience des cellules grâce à un programme de rajeunissement cellulaire afin d’inverser les maladies, les blessures et les handicaps qui peuvent survenir tout au long de la vie.
28. BioViva Science (Liz Parrish). BioViva s’engage à prolonger la durée de vie humaine en bonne santé grâce à la thérapie génique AAV et CMV (en collaboration avec Integrated Health Systems).
29. Longevity Escape Velocity Foundation (Aubrey de Grey). Existe pour identifier et traiter de manière proactive les obstacles les plus difficiles sur la voie de la généralisation de traitements véritablement efficaces pour prévenir et inverser les maladies liées à l’âge chez l’homme.
30. Rejuvenate Bio (George Church). Rendra les chiens (et plus tard les humains) « plus jeunes » en ajoutant de nouvelles instructions ADN à leur organisme.
31. Dog Aging Project. L’objectif du Dog Aging Project est de comprendre comment les gènes, le mode de vie et l’environnement influencent le vieillissement. Nous voulons utiliser ces informations pour aider les gens à augmenter leur espérance de vie en bonne santé, c’est-à-dire la période de leur vie pendant laquelle ils ne souffrent d’aucune maladie.
32. National Institute of Aging (États-Unis). Dirige un vaste effort scientifique visant à comprendre la nature du vieillissement et à prolonger les années de vie en bonne santé et actives. Le programme ITP (Interventions Testing Program) est un programme évalué par des pairs et conçu pour identifier les agents qui prolongent la durée de vie et la durée de vie en bonne santé chez les souris.
33. L’Institut Pasteur de Lille, fondé en 2003 par le professeur Miroslav Radman et le professeur Marija Alačević, est un centre de recherche qui mobilise 34 équipes de recherche et vise à déchiffrer les mécanismes physiopathologiques essentiels des maladies les plus impactantes, en particulier les maladies infectieuses, afin de comprendre ces maladies, de ralentir leur développement et d’imaginer les traitements de demain.
34. Salk Institute (Juan Carlos Izpisua Belmonte). L’institut est une organisation indépendante à but non lucratif et un monument architectural : petit par choix, intime par nature et intrépide face à tous les défis. Qu’il s’agisse du cancer, de la maladie d’Alzheimer, du vieillissement ou du diabète.
35. Buck Institute for Research on Aging, dont la mission est de mettre fin à la menace des maladies liées à l’âge pour les générations actuelles et futures.
36. Glenn Consortium for Research in Aging (11 centres). Prolonger les années de vie en bonne santé grâce à la recherche sur les mécanismes biologiques qui régissent le vieillissement humain normal et le déclin physiologique qui y est associé, afin de traduire la recherche en interventions.
37. Life Biosciences (David Sinclair et Nir Barzilai). Recherche et développement sur les thérapies pour la santé humaine. (Voir également Elixir Pharmaceuticals et Sirtris Pharmaceutical)
38. Longevity Research Institute (Joe Betts-Lacroix, Sarah Constantin, Jaan Tallinn). Un traitement permettant d’allonger la durée de vie en bonne santé des êtres humains permettrait d’éviter des années de maladie grave à des milliards de personnes. Projet de conception, de financement et de lancement d’études sur la durée de vie des animaux pour les interventions les plus prometteuses en matière de longévité.
39. Retro Biosciences. La mission est d’ajouter 10 ans à la durée de vie humaine en bonne santé. Nous commençons par la reprogrammation cellulaire, l’autophagie et les thérapies inspirées du plasma.
40. International Longevity Alliance. Promouvoir la recherche et la défense de la longévité, du niveau local au niveau international. Elle regroupe plus de 75 associations à but non lucratif travaillant dans plus de 65 pays.
41. Hevolution. Finance des initiatives visant à prolonger la durée de vie humaine en bonne santé et à comprendre les processus du vieillissement.
42. Lifespan Research Institute. Collecte des fonds et sensibilisation à la recherche scientifique sur le processus de vieillissement et participation directe à des projets de recherche.
43. XPrize Healthspan. Prix de 101 millions de dollars récompensant les thérapies innovantes qui restaurent les fonctions musculaires, cognitives et immunitaires d’au moins 10 ans afin de permettre à chacun de vieillir en bonne santé.
Présence de Heales lors de certaines conférences et activités
44. Web2Day. L’homme qui vivra 100 ans est déjà né. 2015.
45. TEDxULB « La vie éternelle : y sommes-nous déjà ? ». Conférence TEDx en 2016 de Didier Coeurnelle, Université libre de Bruxelles (Belgique).
46. 2017 : Longévité : un vieux rêve de l’humanité, peut-être le plus beau | Didier Coeurnelle | TEDxBelfort.
47. « Après-midi d’étude : le vieillissement » Conférencier invité / intervenant
9 décembre 2019, Bruxelles (espérance de vie en bonne santé ; organisé par le Service public fédéral belge Sécurité sociale).
48. Projets de longévité pour l’Afrique. Présentation lors d’une conférence en 2019.
49. Transvision 2022, Paris. En route vers l’immortalité.
50. Sommet sur la longévité à Dublin. Conférencier en 2022, 2023 et 2024.
51. TransVision Utrecht 2024. Présentation orale Heales.
52. Transvision Abidjan 2025. Longévité, égalité, fraternité.
Conférences de Heales
53. Le 1er Eurosymposium sur le vieillissement en bonne santé (EHA) s’est tenu en 2012. Les discussions qui se sont déroulées sur trois jours ont porté sur des thèmes tels que : la biologie du vieillissement est désormais une science solide qui peut prolonger la vie en bonne santé, des exemples concrets de recherche et d’innovation pour prolonger la vie en bonne santé, et une rencontre entre les parties prenantes pour construire ensemble les innovations.
54. Le 2e Eurosymposium sur le vieillissement en bonne santé s’est tenu les 1er et 2 octobre 2014.
55. Le 3e Eurosymposium sur le vieillissement en bonne santé s’est tenu les 29 et 30 septembre et le 1er octobre 2016.
56. Le 4e Eurosymposium sur le vieillissement en bonne santé s’est tenu du 7 au 9 novembre 2018.
57. Le 5e Eurosymposium sur le vieillissement en bonne santé s’est tenu le 1er octobre 2020 sur Zoom. Comment prolonger considérablement la durée de vie en bonne santé. Il a adopté une déclaration sur les biomarqueurs et les tests cliniques.
58. 11 février 2021. Conférence et ateliers. Clarifier si et dans quelle mesure les approches anti-vieillissement actuelles fonctionnent chez les souris ou chez les humains.
59. CONFÉRENCE VIRTUELLE sur le big data, l’intelligence artificielle et la longévité en bonne santé. Comment progresser plus rapidement et mieux pour tous les scientifiques ? Jeudi 9 septembre 2021
60. 6e Eurosymposium sur le vieillissement en bonne santé (EHA). Cette réunion s’est tenue en ligne les vendredi 25 et samedi 26 novembre 2022. Elle a adopté une Déclaration pour une prolongation radicale de la durée de vie en bonne santé : Après la Covid, place au rajeunissement.
61. Partager les données de santé et les connaissances en matière d’IA pour la longévité en Europe et dans le monde. La conférence a exploré les dernières avancées en matière d’IA et de mégadonnées dans le domaine de la recherche sur la longévité. 29 février 2024. Elle a adopté une déclaration sur le partage des données de santé et l’utilisation de l’IA pour une longévité en bonne santé.
62. 7e Eurosymposium sur le vieillissement en bonne santé. Vendredi 22 novembre et samedi 23 novembre 2024, « Partage des données de santé et des connaissances en matière d’IA pour la longévité en Europe ».
Heales dans les médias
63. 2014 : Sciences humaines : Immortalité : l’avis de Didier Coeurnelle
64. 2014 : chaîne RTL Belgique, un numéro de l’émission Controverses intitulé « Bientôt tous immortels ? » Didier Coeurnelle
65. 2017 : Pour augmenter la longévité humaine – Didier Coeurnelle, Long Long Life
66. 2018 : interview de Didier Coeurnelle, radio belge RTBF.
67. 2018: journal télévisé de la RTBF, interview notamment d’Aubrey de Grey et Didier Coeurnelle.
68. 2025 : Sven Bulterijs : Journal néerlandais Interview sur les horloges biologiques spécifiques à certains organes (Het Nieuwsblad)
69. 2025 : Sven Bulterijs : Interview sur l’allongement de la durée de vie à la suite des remarques de Poutine et Xi (VRT News)
Activités soutenues par Heales
70. Leucadia Therapeutics. Étude sur les furets en rapport avec la maladie d’Alzheimer. Théorie selon laquelle la réduction de la taille des ouvertures due à l’ossification entraîne des changements comportementaux et morphologiques du cerveau.
71. Une étude sur des rats âgés. Pour tester la longévité après injection d’une fraction plasmatique portant le nom provisoire d’« Elixir » à des rats âgés (6 rats âgés expérimentaux + 6 rats âgés témoins). Cette expérience a été menée sous la direction du professeur Harold Katcher à Mumbai, en collaboration avec Heales.
72. Une autre étude sur des rats âgés. Pour tester la longévité après une transfusion de plasma de rats jeunes (9 rats âgés testés + 8 rats âgés témoins). Cette expérience a été menée sous la direction du professeur Rodolfo Goya à l’Institut de recherche biochimique en Argentine, en collaboration avec Heales.
73. Projet DataBeta Test visant à comparer les marqueurs épigénétiques après avoir testé différents compléments alimentaires, différents régimes alimentaires et différents programmes d’exercice physique.
74. Projet avec Longeavus Technologies. Combinaison de thérapies connues et présumées pour la longévité afin de prolonger radicalement la durée de vie des souris
75. LongevityGPT est un outil d’IA qui utilise des techniques de recherche spécifiques à un domaine et des techniques d’IA avancées pour aider à répondre à des questions de recherche sur la longévité et la génétique en intégrant des bases de données scientifiques et en améliorant la précision de la recherche d’informations biomédicales. Le principal scientifique à l’origine de ce projet est Anton Kulaga
76. Projet avec Nicolas Chernavsky visant à reproduire l’une des expériences de l’étude d’Harold Katcher, qui a démontré le rajeunissement de rats âgés à l’aide de particules extracellulaires dérivées du plasma sanguin de jeunes porcs.
77. La Longevity Escape Velocity Foundation a reçu un don de 200 000 euros de Didier Coeurnelle, avec une promesse de don supplémentaire pouvant atteindre 200 000 euros, sous réserve de dons équivalents collectés avant le 31 octobre 2024. Ce financement a permis de soutenir les travaux pilotes préalables à la prochaine phase du projet Robust Mouse Rejuvenation, la première phase, qui a débuté en février 2023, étant désormais terminée.
Sport et exercice physique liés à la longévité
78. Marche régulière
79. Musculation
80. Entraînement par intervalles à haute intensité (HIIT)
81. Cyclisme
82. Natation
83. Entraînement à l’équilibre
84. Travail de souplesse / mobilité
85. Activité physique quotidienne (mouvements non liés à l’exercice)
86. Capacité cardiorespiratoire
87. La régularité plutôt que l’intensité
Aliments pouvant contribuer à la longévité
88. Huile d’olive (composante du régime méditerranéen)
89. Poissons gras (riches en oméga-3) (qui font partie du régime alimentaire d’Okinawa)
90. Grenade
91. Noix
92. Légumes verts à feuilles
93. Baies
94. Aliments fermentés (qui font partie du régime alimentaire japonais)
95. Fruit de la passion
96. Thé vert et café
97. Chocolat noir (riche en cacao)
Facteurs sociaux favorisant la longévité
98. Liens sociaux solides
99. Interactions sociales régulières
100. La croyance en Dieu
101. Relations intergénérationnelles
102. Être marié ou en couple (du moins pour les hommes)
103. Engagement culturel
104. Se sentir utile aux autres
Biomarqueurs de longévité
105. Âge biologique (âge épigénétique)
106. Fréquence cardiaque au repos
107. VO₂ max
108. Force de préhension
109. Glycémie à jeun
110. HbA1c
111. Marqueurs inflammatoires (par exemple, CRP)
112. Rapport cholestérol LDL/HDL
113. Pression artérielle
114. Masse musculaire
Gènes liés à la longévité
115. FOXO3
116. APOE
117. SIRT1
118. SIRT6
119. Gènes de la voie IGF-1
120. Gènes de la voie mTOR
121. TP53
122. CETP
123. KLOTHO
124. LMNA
Produits pour la longévité :
125. NMN (mononucléotide de nicotinamide) précurseur du NAD⁺ pour l’énergie cellulaire et le soutien au vieillissement.
126. NR (nicotinamide riboside) autre précurseur du NAD⁺ favorisant la santé mitochondriale
127. Resvératrol polyphénol censé activer les voies de la longévité.
128. Fisétine sénolytique naturel (élimine les cellules sénescentes).
129. Quercétine antioxydant souvent associé à la fisétine pour la sénolyse.
130. Spermidine favorise l’autophagie et le renouvellement cellulaire.
131. Astaxanthine antioxydant qui soutient les mitochondries et lutte contre le vieillissement.
132. Coenzyme Q10 (CoQ10) favorise la production d’énergie et la santé cardiovasculaire.
133. Curcumine antioxydant anti-inflammatoire.
134. Pterostilbène antioxydant similaire au resvératrol avec une biodisponibilité plus élevée.
135. Rapamycine (Sirolimus) inhibiteur mTOR dont l’efficacité pour prolonger la durée de vie a été démontrée dans des études sur des animaux.
136. Metformine médicament contre le diabète présentant des avantages potentiels en matière de longévité.
137. Combinaisons de médicaments sénolytiques (par exemple, dasatinib + quercétine) élimination ciblée des cellules sénescentes.
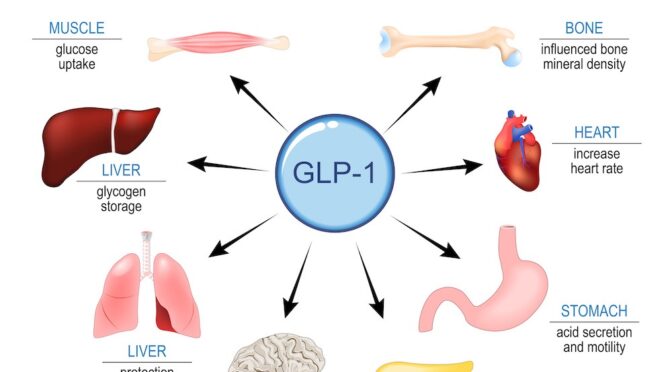
138. Agonistes du récepteur GLP-1 (par exemple, le semaglutide) médicaments contre le diabète/la perte de poids ayant des effets bénéfiques potentiels sur le vieillissement systémique.
139. Inhibiteurs du SGLT2 médicaments cardioprotecteurs et néphroprotecteurs pouvant avoir des effets bénéfiques sur la longévité
140. Acides gras oméga-3 (huile de poisson DHA/EPA) effets cardiovasculaires et anti-inflammatoires liés à un vieillissement en bonne santé.
141. Vitamine D (plus vitamine K2) favorise la santé osseuse, la fonction immunitaire et les marqueurs de longévité cellulaire.
142. Alpha-cétoglutarate (AKG) intermédiaire métabolique lié à la réduction de l’inflammation et au soutien du métabolisme énergétique.
143. Mélanges de compléments Longevity Complete™ produits commerciaux à plusieurs ingrédients combinant des précurseurs du NAD⁺, du CoQ10, des antioxydants et d’autres agents de longévité.
Faits moins connus dans la recherche sur le vieillissement
144. Les requins sont moins souvent atteints de cancer que les autres espèces, probablement en raison d’un taux de mutation lent.
145. Certaines méduses peuvent revenir à leur forme juvénile à plusieurs reprises, ce qui revient essentiellement à « rajeunir ».
146. Le rythme du sommeil a une incidence sur la durée de vie : les personnes ayant des habitudes de sommeil irrégulières vieillissent plus rapidement.
147. Une exposition au froid extrême peut déclencher des mécanismes de longévité chez les humains et les animaux.
148. Certains régimes alimentaires pauvres en protéines, sans réduction calorique, peuvent prolonger la durée de vie.
149. L’âge de votre peau peut différer considérablement de votre âge biologique interne.
150. Les zones bleues ont des habitudes sociales uniques qui peuvent être aussi importantes que l’alimentation.
151. Certaines espèces à longue durée de vie ont naturellement tendance à avoir un taux de glycémie très stable.
152. Le raccourcissement des télomères n’est pas le seul indicateur du vieillissement : il existe d’autres boucles protectrices d’ADN.
153. Une bonne santé cardiovasculaire peut prolonger la durée de vie davantage qu’un régime alimentaire seul.
154. Certains rongeurs à longue durée de vie résistent presque totalement au cancer.
155. L’enrichissement de l’environnement peut ralentir le vieillissement cérébral chez les mammifères.
156. Certaines molécules d’ARN peuvent influencer la longévité indépendamment de l’ADN.
157. La transplantation mitochondriale chez les animaux de laboratoire peut améliorer la fonction tissulaire.
158. Certains animaux défient la règle « taille contre durée de vie » : les petites chauves-souris peuvent vivre plus de 40 ans.
159. Certaines tortues peuvent survivre sans oxygène pendant des heures en ralentissant considérablement leur métabolisme.
160. Une exposition intermittente à une chaleur modérée (comme l’utilisation d’un sauna) est associée à une plus longue durée de vie chez les humains.
161. Les baleines, qui ont une longue durée de vie, accumulent moins de mutations nocives dans leur ADN au fil du temps.
162. Certaines espèces de poissons cavernicoles vivent plus longtemps que les poissons de surface, malgré des conditions difficiles.
163. Des interactions sociales régulières peuvent protéger les télomères et ralentir le vieillissement cellulaire. (Plus d’informations dans la partie exercice)
Mauvaises nouvelles (il reste encore un long chemin à parcourir)
164. Aucune souris au monde n’a aujourd’hui plus de 4 ans (et la situation était légèrement meilleure dans le passé).
165. Aucun être humain n’a plus de 116 ans (et la personne la plus âgée jamais recensée, Jeanne Calment, a vécu 6 ans de plus).
166. La pollution par les microplastiques augmente rapidement et atteint notre cerveau. Nous ne savons pas comment l’arrêter.
167. Pour vivre plus longtemps, il n’y a toujours rien de mieux que ce que vos parents vous ont dit.
168. La loi d’Eroom. La création de nouveaux médicaments devient plus lente et plus coûteuse.
169. Pendant la pandémie de Covid, l’espérance de vie dans le monde a diminué pour la première fois depuis 70 ans, malgré des dépenses de santé plus élevées que jamais.
170. L’espérance de vie aux États-Unis stagne, bien que ce pays dépense plus d’argent pour la santé que tout autre pays et compte parmi les meilleurs scientifiques au monde.
171. L’immortalité (biologique) semble à portée de main depuis plus de 60 ans, à tort jusqu’à présent.
172. L’espérance de vie n’augmente pas plus rapidement au XXIe siècle qu’au XXe siècle.
173. L’échec des médicaments et des thérapies contre la maladie d’Alzheimer chez l’homme est proche de 100 %.
Découvertes et technologies
174. L’inhibition de mTOR prolonge la durée de vie (effets de la rapamycine chez différentes espèces).
175. Les cellules sénescentes favorisent le vieillissement et leur élimination améliore la durée de vie en bonne santé.
176. Les médicaments sénolytiques éliminent sélectivement les cellules sénescentes.
177. Les horloges épigénétiques mesurent avec précision l’âge biologique.
178. Une reprogrammation cellulaire partielle peut inverser les marqueurs du vieillissement sans perte d’identité.
179. L’inflammaging est identifié comme un mécanisme central des maladies liées à l’âge.
180. Le dysfonctionnement mitochondrial est une cause fondamentale du vieillissement.
181. L’épuisement des cellules souches est reconnu comme une caractéristique du vieillissement.
182. Le microbiome intestinal influence le vieillissement et la durée de vie.
183. Identification de mimétiques de la restriction calorique (par exemple, la metformine, la rapamycine)
184. Effondrement de la protéostasie lié à la neurodégénérescence et au vieillissement
185. Accumulation des dommages causés à l’ADN et déclin de la réparation liés à la vitesse du vieillissement
186. Le vieillissement du système immunitaire (immunosénescence) a été cartographié et quantifié.
187. Les Les facteurs sanguins « juvéniles » circulants influencent le vieillissement (parabiose hétérochronique)).
188. Caractérisation formelle des différences entre les sexes dans la biologie du vieillissement
189. Le vieillissement défini comme un processus biologique traitable, et non comme un simple facteur de risque
190. Le vieillissement peut être partiellement inversé par la reprogrammation cellulaire (facteurs Yamanaka).
191. Édition génétique CRISPR (et autres thérapies génétiques)
192. Découverte de médicaments grâce à l’IA
193. Séquençage unicellulaire
194. Organoïdes
195. Tracers de santé portables
196. Jumeaux numériques en médecine
197. Thérapies à base de cellules souches
198. Diagnostics avancés (multi-omiques)
199. Robotique pour les soins aux personnes âgées
La bonne nouvelle du mois.
200. Nous vivons plus longtemps que jamais dans toute l’histoire de l’humanité. En moyenne, 73 ans dans le monde. 85,5 ans à Hong Kong.
Pour plus d’informations
Heales, Longevity Escape Velocity Foundation, International Longevity Alliance, Longecity et Lifespan.io
Heales Monthly Science News
Chaîne YouTube Heales
Contactez-nous