Introduction
Le vieillissement (ou sénescence) a été l’objet au cours de ces dernières années de nombreuses recherches scientifiques. Atteindre un âge avancé tout en restant en bonne santé a été pendant longtemps considéré comme une utopie. De nos jours, les scientifiques cherchent à analyser, comprendre et ralentir les causes du vieillissement.
La lutte contre le vieillissement est aussi une lutte avec notre métabolisme et les différentes causes qui accélèrent ce processus. Dans ce texte, nous allons explorer les neuf principales causes du vieillissement chez les humains, telles que décrites dans un article très connu des spécialistes: Hallmarks of aging (les piliers du vieillissement) publié dans la revue Cell en 2013.
Ces neuf causes ont été subdivisées en trois sous-classes: les causes primaires, les antagonistes du vieillissement, et enfin les causes secondaires du vieillissement qui découlent des deux premières.
Causes primaires
- Dégradations de l’ADN

L’ADN est le porteur du matériel génétique qui confère à l’homme certaines caractéristiques spécifiques à sa personne. Il est constitué d’un grand nombre de nucléotides qui servent à coder en formes de gènes l’information génétique des êtres vivants. Le génome est la combinaison unique de gènes d’une personne, autrement dit ses caractéristiques génétiques. Il est essentiellement situé dans le noyau des cellules eucaryotes.
Lors de la division cellulaire (mitose), l’information génétique contenue dans la cellule mère va se dupliquer et être transmise à chacune des cellules filles, processus défini comme réplication de l’ADN.
Certaines habitudes de vies (cigarettes, alimentations…) et d’autres causes internes ou externes peuvent agir sur le bon fonctionnement du génome au fil du temps, et donc faire accumuler des erreurs au niveau de la réplication de l’ADN. Ces erreurs peuvent soit, se réparer d’elles-mêmes, soit, occasionner la mort de la cellule mère (apoptose) ou encore être transmises aux cellules filles.
Réparation des dégâts au niveau de l’ADN:
Notre organisme contient certains gènes qui fabriquent des protéines visant à réparer les dégâts causés au cours de la réplication de l’ADN. Mais la question est: “qu’en est-il de ce système de réparation quand notre organisme atteint un certain âge ?”
Les différents coenzymes qui participent au mécanisme de réparation des lésions au niveau du génome ont tendance à diminuer avec l’âge. Parmi eux, le NAD+. Plusieurs études ont été faites dans ce domaine, dans le but de trouver une corrélation entre notre taux de NAD+ et la capacité de notre organisme à réparer les lésions au niveau de l’ADN.
Ce qu’il faut retenir, c’est que les lésions au niveau de l’ADN lors de sa réplication, peuvent soit entraîner la mort cellulaire ou répliquer des cellules défectueuses. L’accumulation de ces lésions constitue l’une des premières causes du vieillissement.
2. Rétrécissement des télomères
Les télomères sont des régions d’ADN dits « non codants » (séquences du génome ne produisant pas de protéines), situés à l’extrémité de chaque chromosome et dont la fonction principale est de protéger les chromosomes.
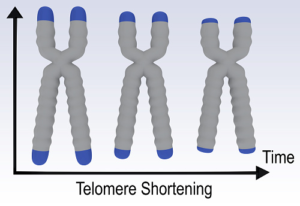
Lors de la division cellulaire, l’enzyme ADN polymérase, responsable de la duplication de l’ADN, ne code pas les derniers nucléotides aux extrémités des chromosomes, donc les télomères. Ainsi, à chaque division, les télomères se raccourcissent un peu plus jusqu’à disparaître totalement. Avec la disparition des télomères, la cellule arrête sa division et meurt. Certaines de nos cellules comme les cellules souches, les germinales et certaines de nos cellules somatiques expriment une enzyme appelée télomérase. Cet enzyme est capable de conserver la longueur des télomères lors de la division cellulaire, en ajoutant une séquence spécifique de nucléotides aux extrémités des chromosomes. Grâce à ce mécanisme, les cellules contenant la télomérase peuvent se répliquer indéfiniment.
Malheureusement, 90% des cellules cancérigènes expriment la télomérase, ce qui les rend capables de se répliquer à l’infini aussi.
Le rétrécissement des télomères fait donc mourir nos cellules et vieillir nos tissus. Cela implique une place importante dans les recherches contre le vieillissement.
3. Épigénétique
L’épigénétique représente l’ensemble des mécanismes pouvant modifier l’expression des gènes sans modifier leur séquence d’ADN.
Trois principaux modes d’action épigénétiques pouvant influencer la durée de vie ont été identifiés:
– La méthylation de l’ADN: phénomène qui consiste à ajouter ou supprimer une molécule de méthyle dans certaines séquences d’ADN. L’expression des gènes peut être modifiée par ces changements qui, en s’accumulant, peuvent causer certains problèmes comme l’augmentation du taux de cholestérol ou alors augmenter les risques des maladies cardiovasculaires.
– L’acétylation des histones: l’acétylation et la désacétylation des histones sont des éléments essentiels de la régulation des gènes. L’acétylation, de même pour la méthylation, est le processus par lequel un groupe fonctionnel acétyle est transféré d’une molécule à un autre. La désacétylation est l’inverse, un groupe acétyle est retiré d’une molécule. Ces changements peuvent, eux aussi, avoir certains effets sur notre organisme et modifier l’expression des gènes.
– Remodelage de la chromatine: la chromatine est la structure au sein de laquelle l’ADN se trouve empaqueté. La chromatine peut se remodeler, se condenser. Sous sa forme la plus condensée, elle s’appelle hétérochromatine, sous sa forme la moins condensée, elle s’appelle euchromatine. Un déséquilibre entre l’hétérochromatine et l’euchromatine peut survenir avec l’âge. Ce déséquilibre va modifier non seulement la stabilité des chromosomes, mais aussi l’expression des gènes.
Ces altérations épigénétiques peuvent donc modifier l’expression des gènes et causer certaines maladies liées à l’âge.
4. Repliement des protéines
Les protéines sont présentes dans chacun des gènes de notre génome. Le repliement des protéines sur elles-mêmes lui permet de bien assurer ses multiples fonctions au sein de notre organisme. Lorsque le repliement des protéines ne se fait pas bien, cela peut être dû soit à une mauvaise structure de l’ADN, soit à une défaillance des deux systèmes de recyclage des briques cellulaires. Ces deux mécanismes se détériorent avec l’âge.
Les protéines mal repliées peuvent s’accumuler dans l’organisme, occasionnant même la mort de certaines de nos cellules. Ce phénomène est associé à de nombreuses maladies liées à l’âge comme, la maladie de Parkinson, la maladie d’Alzheimer … Il est donc considéré comme l’une des causes primaires du vieillissement.
Les antagonistes du vieillissement
Il s’agit de mécanismes au départ censés nous protéger, mais qui deviennent finalement nuisibles à l’organisme.
5. Le dysfonctionnement des mitochondries
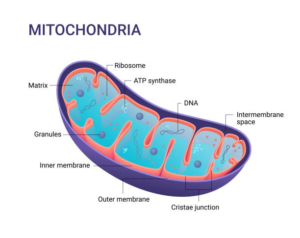
Les mitochondries sont les centrales énergétiques des cellules. Elles maintiennent la respiration cellulaire et contribuent à l’essentiel de la production d’ATP (qui fournit l’énergie). Les mitochondries contiennent leurs propres gènes, l’ADN mitochondrial. Les anomalies de ces gènes sont associées à des troubles neurologiques.
Les mitochondries produisent des déchets, les radicaux libres. Ces radicaux libres par oxydation créent des dommages à l’ADN mitochondrial et aux protéines. Le processus de stress oxydatif déclenche le mécanisme d’autophagie afin d’éliminer les mitochondries endommagées.
La deuxième cause qui lierait les mitochondries au vieillissement, pourrait être la communication entre le noyau de la cellule et ses mitochondries. Avec le vieillissement, ces communications se dégradent.
6. Les voies de détection des nutriments
Notre organisme adapte le comportement des cellules en fonction de la quantité de nutriments dont ils disposent. Le vieillissement altère le processus. Les voies de détection de nutriment se dégradent. Cela peut provoquer l’athérosclérose, cause dominante des maladies cardiovasculaires qui sont la principale cause de mortalité chez les plus de 70 ans.
7. La sénescence des cellules
Une cellule sénescente est une cellule vieillissante dont les fonctions se dégradent. Elle cesse de se diviser et son activité change. Lors de ce changement, une cellule normale va commencer à changer de métabolisme et peut se mettre à sécréter des molécules pro-inflammatoires qui peuvent, à leur tour, dégrader la santé des cellules environnantes.
Les cellules sénescentes peuvent être détruites par le système immunitaire. Mais ce système diminue en efficacité avec l’âge. Donc le vieillissement fait accumuler les cellules sénescentes qui à leur tour vont dégrader encore plus de cellules environnantes.
Causes secondaires
8. L’épuisement des cellules souches
Les cellules souches sont des cellules indifférenciées ou partiellement différenciées. Alors que les cellules normales ne sont capables de se diviser qu’un nombre limité de fois (ce qui est appelé la limite de Hayflick), les cellules souches sont capables de se diviser en principe indéfiniment.
Cependant, avec le vieillissement, la capacité des cellules souches diminue. augmentant le nombre de cellules sénescentes présentes dans les tissus et entraînant divers problèmes en fonction de l’organe touchés.
9. Inflammation
L’inflammation est un phénomène complexe qui se produit lors d’une agression externe ou interne sur des tissus. Les cellules de notre corps peuvent émettre des signaux en fonction du stress auquel elles sont soumises. Elles synthétisent des molécules appelées cytokines, pour réguler la réponse inflammatoire. Il existe aussi des molécules anti-inflammatoires qui permettent de réguler la réponse inflammatoire. Il s’agit d’atteindre un équilibre pour que la réponse immunitaire ne soit ni trop faible ni trop élevée. Avec l’âge, les inflammations deviennent plus importantes et les régulations deviennent moins efficaces. Ce déséquilibre va occasionner ce qui est appelé l’inflamagging.
Conclusion
Voici donc décrits les aspects du vieillissement selon la catégorisation la plus acceptée aujourd’hui.
Il existe de nombreuses autres théories relatives au vieillissement, notamment la théorie développée dans le cadre des Strategies for Engineering Negligeable Senescence avec non pas neuf, mais sept causes.
L’extrême complexité de la sénescence signifie-t-elle que nous ne pouvons ralentir le vieillissement sans s’attaquer à tous les aspects ? Non, car les causes de vieillissement sont très similaires au moins pour de nombreuses espèces de mammifères. Or, ces espèces ont des durées de vie très différentes. Par contre, pour obtenir des progrès considérables, une prise en compte de tous les aspects de la sénescence sera vraisemblablement nécessaire.
