“Ik voorspel dat het op een dag normaal zal zijn om naar een dokter te gaan en een recept te krijgen voor een medicijn dat je een decennium terug zal brengen”. zei Sinclair op een evenement in Californië.
“Er is geen reden waarom we geen 200 jaar zouden kunnen leven.” David Sinclair, die een verouderingsonderzoekslaboratorium leidt aan Harvard University, zegt dat de nieuwe therapieën mensen in staat zouden kunnen stellen veel langer te leven dan nu het geval is.
Het thema van deze maand: Neurodegeneratieve ziekten en veroudering
Inleiding
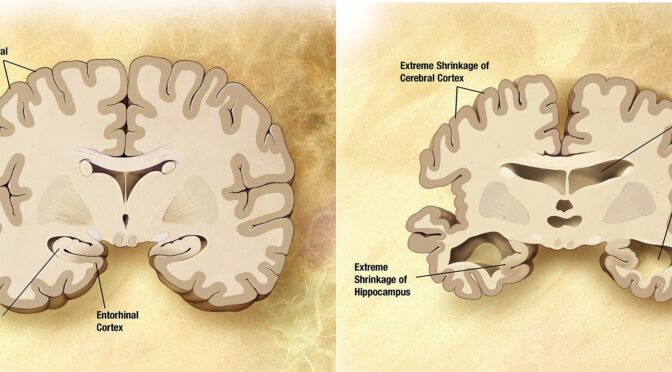
Van alle ouderdomsziekten is de ziekte van Alzheimer waarschijnlijk de meest bestudeerde. Helaas is het ook nog steeds een ongeneeslijke, veel voorkomende ziekte.
Zouden we allemaal sterven aan degeneratieve ziekten als we alle andere doodsoorzaken die verband houden met veroudering konden onderdrukken? Waarschijnlijk wel, en dat is niet de leukste manier om ouder te worden en te sterven (als die er al is). En tot nu toe zijn geen van alle veelbelovende therapieën wereldwijd succesvol maar ze brachten wele veelbelovende ontdekkingen om deze ziekten te begrijpen en de ziekten zelfs af te remmen op diermodellen.
We hebben meer werk, meer klinische proeven en meer verbeelding nodig om op dit gebied vooruitgang te boeken.
Veroudering als riskrisicofactor voor neurodegeneratieve ziekten
De belangrijkste risicofactor voor de meeste neurodegeneratieve ziekten is veroudering, waaronder de ziekte van Alzheimer (AD) en de ziekte van Parkinson (PD). De meeste mensen met AD zijn 65 jaar of ouder en de prevalentie blijft toenemen met het toenemen van de leeftijd. Weefsels die hoofdzakelijk bestaan uit postmitotische cellen, zoals de hersenen, zijn bijzonder gevoelig voor de gevolgen van veroudering. De ziekte ontwikkelt zich onomkeerbaar en gaat gepaard met hoge sociaal-economische en persoonlijke kosten. De negen biologische kenmerken van veroudering zijn genomische instabiliteit, telomeerverlies, epigenetische veranderingen, verlies van proteostase, mitochondriale disfunctie, cellulaire veroudering, ontregelde nutriëntsensatie, uitputting van stamcellen en veranderde intercellulaire communicatie.
Veroudering is de belangrijkste risicofactor voor de meeste neurodegeneratieve ziekten, waaronder de ziekte van Alzheimer en de ziekte van Parkinson.
De studie Cognitive Trajectories and Resilience in Centenarians (“Cognitieve trajecten en veerkracht bij honderdjarigen”) werd uitgevoerd bij 340 zelfgerapporteerde cognitief intacte honderdjarigen. Vierenveertig van deze deelnemers werden neuropathologisch onderzocht en er werden tests uitgevoerd met een bereik voor de steekproef van 0 tot 4 jaar.
Er zijn enkele belangrijke bevindingen uit dit werk. Gedurende 1,6 jaar follow-up werd geen achteruitgang van de cognitieve functie waargenomen, behalve een geringe achteruitgang van het geheugen. Dit wijst erop dat de incidentie van dementie bij deze groep honderdjarigen laag was en wijst op veerkracht of weerstand tegen AD en verwante vormen van dementie, ondanks het feit dat zij de krachtigste risicofactor van de algemene bevolking hadden, namelijk extreme ouderdom, en dat de afzetting van amyloïde-β en tau??? in de hersenen over het algemeen toeneemt met de leeftijd.
Verschillende studies ondersteunen de hypothese dat honderdjarigen eerder profiteren van beschermende mechanismen dan van een relatieve afwezigheid van neurodegeneratieve oorzakelijke factoren.
Alzheimer plaques en tau proteïnen…
De ziekte van Alzheimer verstoort de overdracht van informatie via elektrische en chemische signalen tussen neuronen, met functieverlies tot gevolg. De schade is wijdverbreid: veel neuronen verliezen verbindingen met andere neuronen, stoppen met functioneren, en sterven af. Alzheimer verstoort processen die essentieel zijn voor neuronen en hun netwerken, zoals communicatie, metabolisme en herstel. Het betrokken beta-amyloïde eiwit komt voor in verschillende moleculaire vormen die zich verzamelen tussen neuronen. Eiwitten klonteren samen tot plaques.
Neurofibrillaire klitten zijn abnormale ophopingen van een eiwit genaamd tau dat zich verzamelt in neuronen. In gezonde neuronen bindt tau zich normaal gesproken aan microtubuli en stabiliseert het deze. Bij de ziekte van Alzheimer echter zorgen abnormale chemische veranderingen ervoor dat tau loskomt van microtubuli en zich vasthecht aan andere tau-moleculen, waardoor draden worden gevormd die uiteindelijk samenklitten in neuronen. Het blijkt dat abnormaal tau zich ophoopt in specifieke hersengebieden die betrokken zijn bij het geheugen. Beta-amyloïde klontert samen in plaques tussen neuronen. Als het niveau van beta-amyloïde een omslagpunt bereikt, verspreidt tau zich snel door de hersenen.
Tests op muizen zijn veelbelovend maar nooit bevestigd
Eén probleem is dat de huidige diermodellen duidelijk niet in staat zijn het volledige scala van bij de mens vastgestelde gebeurtenissen, bijvoorbeeld neuronaal verlies, weer te geven. Er zij op gewezen dat, in een recent verslag waarbij een Drosophila-model is gebruikt, wordt gesuggereerd dat neuronaal verlies bij AD beschermend kan werken. Dit opent de deur naar een nieuwe hypothese die, indien bewezen, nogal atypisch zou zijn zoals bij andere neurodegeneratieve aandoeningen, zoals de ziekten van Parkinson en Huntington, waar neuronaal verlies het belangrijkste neuropathologische kenmerk is.
Een nieuw, door RIKEN-onderzoekers ontwikkeld muismodel kan verbetering brengen in de situatie dat veel verbindingen die veelbelovend bleken in muismodellen van de ziekte vervolgens flopten in klinische proeven op mensen. Omdat zij zo snel de kenmerkende hersenafwijkingen ontwikkelen die met de ziekte van Alzheimer in verband worden gebracht, zouden de muizen de onderzoekers in staat moeten stellen op efficiënte wijze kandidaten voor ziekteverbeterende therapieën te screenen.
Hebben vrouwen vaker de ziekte?
Dat vrouwen langer leven dan mannen is waarschijnlijk niet het hele antwoord op de vraag waarom vrouwen meer kans hebben om de ziekte te ontwikkelen dan mannen. De kans dat u op latere leeftijd de ziekte van Alzheimer krijgt, is iets groter als u een vrouw bent dan een man. Een studie volgde 16.926 mensen in Zweden en stelde vast dat vrouwen vanaf ongeveer 80 jaar meer kans hadden om de diagnose te krijgen dan mannen van dezelfde leeftijd. En uit een meta-analyse van de incidentie van de ziekte in Europa bleek dat jaarlijks ongeveer 13 vrouwen op 1000 Alzheimer ontwikkelen, tegenover slechts 7 mannen.
Een mogelijke reden:
- De amyloïde plaques die de ziekte van Alzheimer veroorzaken, kunnen deel uitmaken van het immuunsysteem van de hersenen om infecties te bestrijden.
- Vrouwen hebben een sterker immuunsysteem dan mannen.
- Als onderdeel van hun sterkere immuunsysteem kunnen vrouwen uiteindelijk meer amyloïde plaques hebben dan mannen.
Met name mitochondriën van jonge vrouwen zijn beschermd tegen amyloïd-beta toxiciteit, genereren minder reactieve zuurstofsoorten en geven minder apoptogene signalen af dan die van mannen. Al deze voordelen gaan echter verloren bij mitochondriën van oude vrouwen. Aangezien oestrogene verbindingen beschermen tegen mitochondriale toxiciteit van amyloïde-bèta, suggereert de oestrogene werking een mogelijke behandelings- of preventiestrategie voor AD.
Mogelijke therapieën
Getransplanteerde stamcellen hebben hun inherente voordelen bij het verbeteren van cognitieve stoornissen en geheugenstoornissen aangetoond, hoewel bepaalde zwakke punten of beperkingen moeten worden overwonnen.
De getransplanteerde neurale stamcellen compenseren het verlies van neuronen en hebben een direct effect op het ontvangende weefsel. Bovendien kunnen deze cellen paracriene cytokinen produceren om een indirect effect op de neurogenese uit te oefenen. De functie van getransplanteerde cellen kan worden verbeterd door preconditionering. Zo kan de transplantatie van getransplanteerde neurale stamcellen die groeifactoren tot expressie brengen, de neurogenese bevorderen en cognitieve stoornissen verbeteren, het ruimtelijk geheugen verbeteren en de leerstoornissen vertragen. De getransplanteerde cellen kunnen echter ook transdifferentiëren in niet-neuronale glia, wat een negatieve gebeurtenis is.
Organoïden
Menselijke neurodegeneratieve ziekten, zoals de ziekte van Alzheimer, zijn niet gemakkelijk in vitro te modelleren vanwege de ontoegankelijkheid van het hersenweefsel en de complexiteit die de bestaande celkweeksystemen vereisen. Driedimensionale hersenorganoïdesystemen, gegenereerd uit menselijke pluripotente stamcellen, hebben aangetoond een aanzienlijk potentieel te hebben voor de recapitulatie van belangrijke kenmerken van de pathofysiologie van de ziekte van Alzheimer, zoals amyloïde plaque- en neurofibrillaire kluwen-achtige structuren. Zij slagen er echter niet in de complexe cel-cel??? interacties van verschillende regio’s van de menselijke hersenen en aspecten van natuurlijke processen zoals celdifferentiatie en veroudering te modelleren.
Eerste klinisch onderzoek naar gentherapie voor de ziekte van Alzheimer bij mensen
Onderzoekers van de University of California San Diego School of Medicine zijn gestart met een eerste klinische proef van fase I bij mensen om de veiligheid en doeltreffendheid te beoordelen van een gentherapie die een belangrijk eiwit aflevert in de hersenen van mensen met de ziekte van Alzheimer of lichte cognitieve stoornis, een??? aandoening die vaak voorafgaat aan volledige dementie.
Het eiwit, neurotrofe factor genaamd, maakt deel uit van een familie van groeifactoren die in de hersenen en het centrale zenuwstelsel worden aangetroffen en die het voortbestaan van bestaande neuronen ondersteunen en de groei en differentiatie van nieuwe neuronen en synapsen bevorderen. Dit is bijzonder belangrijk in hersengebieden die gevoelig zijn voor degeneratie bij AD.
Diepe hersenstimulatie voor Parkinson
Voor mensen met de ziekte van Parkinson die niet goed reageren op medicijnen, kan de arts diepe hersenstimulatie aanbevelen. Tijdens een chirurgische ingreep implanteert een arts elektroden in een deel van de hersenen en verbindt deze met een klein elektrisch apparaat dat in de borstkas wordt geïmplanteerd. Het apparaat en de elektroden stimuleren pijnloos specifieke gebieden in de hersenen die de beweging controleren, op een manier die kan helpen om veel van de bewegingsgerelateerde symptomen van Parkinson, zoals tremoren, trage bewegingen en stijfheid, te stoppen. Dit werkt helaas slechts voor een bepaalde tijd.
Conclusie
We weten meer over neurodegeneratieve ziekten en met name de ziekte van Alzheimer dan over andere ziekten die we kunnen genezen. Toch negeren we nog steeds fundamentele vragen en moeten we antwoorden vinden:
- Wat is het echte oorzaak van de ziekte?
- Wat versnelt de ziekte precies?
- Is de accumulatie van tau-eiwitten en amyloïde-eiwitten de oorzaak of het gevolg van de ziekte (het antwoord is waarschijnlijk “beide”, maar in welke mate?)?
- En natuurlijk, wat zijn de werkende therapieën om de ziekte te stoppen of op zijn minst te vertragen?
Goed nieuws van de maand: Langst levende (Sprague-Dawley stam) rat genaamd Sima is 47 maanden oud en leeft nog steeds.
Therapie die jong plasma nabootst zou de weg kunnen wijzen naar een lang leven, schreef de Longevity Technology. De laatste oudste rat vóór dit experiment stierf op 45,5 maanden, de rat in het huidige experiment heeft dus al langer geleefd. The Guardian citeert de bekende wetenschapper, Prof Steve Horvath: “Ik denk dat de resultaten verbluffend zijn. Sommige mensen zullen de resultaten bekritiseren vanwege de kleine steekproefgrootte. Eén zwaluw maakt nog geen zomer. Maar ik geloof de resultaten omdat verschillende aanvullende studies ze ondersteunen.”
Heales sponsorde het experiment van Harold Katcher en de startup Yuvan, waarbij het product E5 wordt gezuiverd van jongere dieren en gegeven aan vrouwelijke ratten van 24 maanden voor verjongingsdoeleinden.
Voor meer informatie